La compañía biofarmacéutica UCB ha anunciado resultados preliminares positivos para Bimzelx® (bimekizumab) en todo el espectro de la espondiloartropatías. Los más recientes su estudio de Fase III BE MOBILE 1 para el tratamiento de pacientes con espondilitis axial no radiográfica (nr-axSpA) y su estudio de Fase III BE COMPLETE para el tratamiento de pacientes con artritis psoriásica activa. Ambos estudios se suman al ya anunciado hace escasas semanas para el tratamiento de la Espondilitis anquilosante a través del estudio Fase III BE MOBILE 2, completando así todo el espectro de las espondiloatropatías.
Resultados preliminares positivos en espondilitis axial no radiográfica (BE MOBILE 1) y espondilitis anquilosante (BE MOBILE 2)
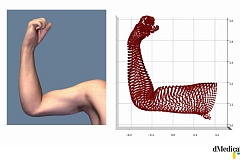
El estudio BE MOBILE 1 es un estudio de Fase III que evalúa la eficacia y seguridad de Bimzelx® (bimekizumab) en el tratamiento de pacientes con espondilitis axial no radiográfica (nr-axSpA). BE MOBILE 1 es uno de los dos estudios paralelos de Fase III que evalúan bimekizumab en el tratamiento de pacientes del espectro de la Espondiloartritis Axial. El segundo estudio, BE MOBILE 2, evalúa la eficacia y seguridad de bimekizumab en el tratamiento de paciente con Espondilitis anquilosante, también conocida como Espondiloartritis axial radiográfica.
El estudio BE MOBILE 1 completó la variable de eficacia primaria, medida por la proporción de pacientes que alcanzó respuesta ASAS40 en la semana 16, comparado con placebo. ASAS40 mide las mejoras en la enfermedad en diferentes dominios, incluida la evaluación global del paciente de la actividad de la enfermedad, el dolor espinal, la función física y la inflamación. De esta forma, la variable de evaluación primaria empleada en este estudio, ASAS40, establece un elevado umbral de mejora en los resultados informados por los pacientes, es decir, al menos una mejora del 40% en relación con el valor inicial.*
El estudio también cumplió todas las variables secundarias de eficacia, incluidas mejoras significativas con bimekizumab frente a placebo en la semana 16 en la actividad de la enfermedad informada por el paciente, medida por el Índice BASDAI; la consecución de ASAS remisión parcial (ASAS-PR) y ASDAS-MI (Mejora relevante en la Puntuación de Actividad de la Enfermedad); y la puntuación del dolor espinal nocturno.
De esta forma, el ensayo alcanzó la variable de eficacia primaria y todas las variables secundarias con significación estadística. “Estamos entusiasmados de compartir los nuevos hallazgos del segundo estudio de Fase III en nuestro programa clínico de bimekizumab en axSpA. Estos resultados positivos, junto con los datos del estudio BE MOBILE 2 que anunciamos hace unas semanas, respaldan el potencial clínico de bimekizumab para mejorar los resultados de los pacientes en todo el espectro de la espondiloartritis axial, que incluye tanto la forma no radiográfica (nr)-axSpA y la espondilitis anquilosante”, afirma Emmanuel Caeymaex, Vicepresidente Ejecutivo de Soluciones de Inmunología y Director de UCB en EE.UU.
“Los resultados que se presentan para bimekizumab para el manejo de la espondilloartritis axial activa no radiográfica (nr-axSpA) brindan una evidencia clara que respalda a bimekizumab en el tratamiento de la nr-axSpA y sugieren que apuntar a IL-17F además de IL-17A puede ser un enfoque de tratamiento prometedor para esta enfermedad reumática crónica y dolorosa que, en la mayoría de los casos, comienza en la edad adulta temprana”, explica el profesor Atul Deodhar, Profesor de Medicina de la División de Artritis y Enfermedades Reumáticas de la Oregon Health & Science University en Portland (EE.UU).
El perfil de seguridad de bimekizumab en BE MOBILE 1, fue congruente con los resultados de seguridad observados en estudios anteriores, sin que se registraran nuevas señales de seguridad. Los resultados principales del estudio BE MOBILE 1 se basan en los resultados positivos principales del estudio BE MOBILE 2 en axSpA radiográfica.
Resultados preliminares positivos en artritis psoriásica (BE COMPLETE)
El estudio BE COMPLETE es un estudio de Fase III que evalúa la eficacia y seguridad de Bimzelx® (bimekizumab) en el tratamiento de pacientes con artritis psoriásica activa, que respondieron inadecuadamente o fueron intolerantes a la terapia anti-factor de necrosis tumoral-alfa (anti-TNF-α).
El estudio BE COMPLETE completó la variable de eficacia primaria, demostrando que significativamente más pacientes tratados con bimekizumab lograron una mejoría del 50% o más en los signos y síntomas de la enfermedad desde el inicio, en comparación con el placebo, según lo medido por la respuesta ACR50 en la semana 16.
El estudio también cumplió todas las variables secundarias de eficacia. Bimekizumab mostró mejoras significativas sobre el placebo en la semana 16 en la función física, según lo medido por el índice de discapacidad del cuestionario de evaluación de la salud (HAQ-DI); aclaramiento de la piel, medido por al menos una mejora del 90% en el índice de área y gravedad de la psoriasis (PASI90); el estado de salud física, medido por la puntuación del Resumen del componente físico (PCS) de la Encuesta de salud de 36 ítems del formulario corto (SF-36); y baja actividad de la enfermedad, medida por el índice de actividad mínima de la enfermedad (MDA).
El perfil de seguridad de bimekizumab en BE COMPLETE, fue congruente con los resultados de seguridad observados en estudios anteriores, sin que se registraran nuevas señales de seguridad.Los resultados de primera línea del estudio BE COMPLETE se basan en los resultados positivos del análisis provisional de primera línea del estudio de Fase III BE OPTIMAL en adultos con artritis psoriásica activa, que nunca habían recibido tratamiento con fármacos biológicos antirreumáticos modificadores de la enfermedad (bDMARD, por sus siglas en inglés), informados en noviembre de 2021.
Con base en los resultados de estos tres estudios, UCB planea presentar solicitudes regulatorias para bimekizumab en axSpA y artritis psoriásica en Estados Unidos y la Unión Europea en el tercer trimestre de 2022.