Cinfa ha destinado seis millones de euros a adecuar sus instalaciones al proceso de serialización de sus medicamentos, de acuerdo al Sistema Español de Verificación de Medicamentos (SEVEM). De este modo, se anticipa a la hora de disponer todo lo necesario para poder responder a la próxima normativa de la Agencia Europea del Medicamento (EMA), que establece como fecha límite para su implantación por parte de todos los laboratorios farmacéuticos el próximo 9 de febrero de 2019.
“La falsificación de medicamentos supone un grave peligro para la salud de las personas, por lo que debemos garantizar su autenticidad antes de ser dispensados al paciente. La adopción de estas medidas de seguridad y la colaboración de todos los agentes del sector serán claves para lograrlo”, explica José Luis Ergui, director comercial de Cinfa.
En este sentido, la compañía ha adaptado la maquinaria e instalaciones de sus dos plantas de producción ubicadas en Pamplona para que sus más de 800 referencias de medicamentos contempladas por la normativa cumplan con los requisitos de seguridad exigidos.
“La normativa ya se aplica en países como Estados Unidos, China o India y permitirá que los estados y las compañías farmacéuticas controlemos la legalidad de los medicamentos dispensados”, comenta Ergui. “Nuestra compañía ha querido adelantarse a la entrada en vigor de esta medida para asegurar al profesional sanitario y al paciente la disponibilidad de nuestros medicamentos con las máximas garantías”, apunta.
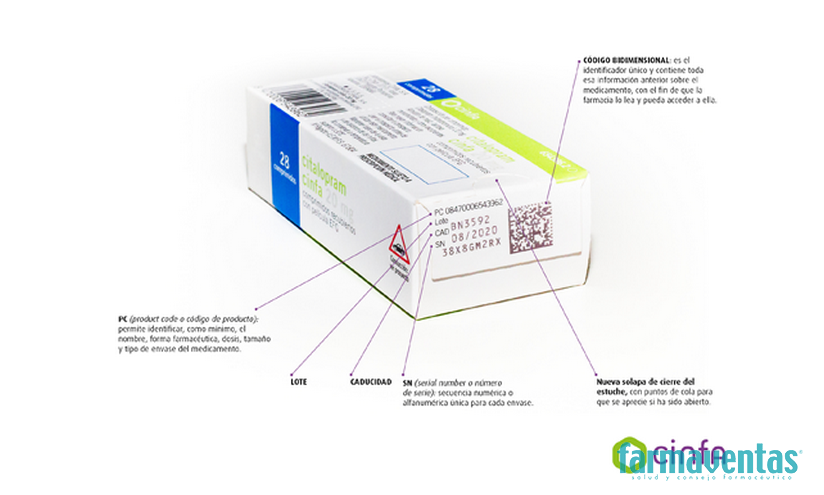
El nuevo sistema de seguridad consta de dos elementos diferenciados: por un lado, un código datamatrix (código de barras de dos dimensiones) que contiene un número de serie único asignado a cada estuche de medicamento y que permitirá verificar su autenticidad así como su identificación. Y por otro, un mecanismo integrado en el estuche del producto -tamper evident en inglés- que, mediante un punto de cola o precinto, asegura que este no haya sido abierto o manipulado.
Para ejecutar este proyecto, que permitirá al laboratorio hacer un seguimiento completo por unidad de venta, se ha necesitado la implicación de una docena de departamentos.
“Se trata de un proyecto transversal en el que todas las modificaciones están relacionadas entre sí y deben desarrollarse de forma coordinada, tanto a nivel interno como externo. No debemos olvidar que la aplicación de estas medidas de seguridad no solo afecta a las farmacias y los laboratorios farmacéuticos en Europa, sino también a nuestros proveedores, que deben adaptar sus medios productivos, instalaciones y sistemas para cumplir con la nueva ley”, indica el director comercial.